- [2023. 3.27.] 연세대학교 미래캠퍼스 홍민선 교수 연구팀, 알츠하이머병 등 퇴행성뇌질환 치료를 위한 타우 항체 공동연구 2023.03.27
-
대외협력부 첨부파일( 6 ) 홍민선-JCI그림(가운데+우).jpg [2023. 3.27.] 연세대학교 미래캠퍼스 홍민선 교수 연구팀, 알츠하이머병 등 퇴행성뇌질환 치료를 위한 타우 항체 공동연구 사진 모음_업로드용.jpg [2023. 3.27.] 연세대학교 미래캠퍼스 홍민선 교수 연구팀, 알츠하이머병 등 퇴행성뇌질환 치료를 위한 타우 항체 공동연구.hwp 홍민선-생명과학기술 교수 증명사진.jpg 박재완증명사진.jpg 홍민선-JCI-그림(좌).png CLOSE TOOLTIP
연세대학교 미래캠퍼스 홍민선 교수 연구팀,
알츠하이머병 등 퇴행성뇌질환 치료를 위한 타우 항체 공동연구

연세대학교 미래캠퍼스 생명과학기술학부 홍민선 교수(좌), 박재완 연구원(우)
o 연세대학교 미래캠퍼스 생명과학기술학부의 홍민선 교수 연구팀이 서울아산병원 울산의대 뇌과학교실 윤승용 교수, 김동호 교수 연구팀과 공동연구를 실시해 알츠하이머병 등 퇴행성 뇌질환의 치료 및 진단에 쓰일 수 있는 단일클론항체 ADEL-Y01의 연구개발 결과를 최근 Medicine, Research & Experimental 분야의 최고권위지인 <Journal of Clinical Investigation(피인용지수(impact factor) 19.46), https://www.jci.org/articles/view/156537>에 게재했다.
o 본 연구에서는 정상적인 타우 단백질이 비정상적인 아세틸 타우로 변화하여 뇌 조직을 손상시키는 타우병증의 분자 기전 및 치료용 항체를 제시했다. 타우병증은 뇌에 손상된 타우 단백질이 축적되며 뇌 세포 사멸과 인지 기능 저하를 일으켜 알츠하이머병의 원인이 된다. 연구에서 개발된 단일 클론 항체 'ADEL-Y01'는 라이신 280에 아세틸화된 타우 단백질(tau-acK280)의 항원 표적하여 타우병증에 대한 효능을 입증하고 항체를 이용한 퇴행성뇌질환 치료 및 진단의 가능성을 제시했다.
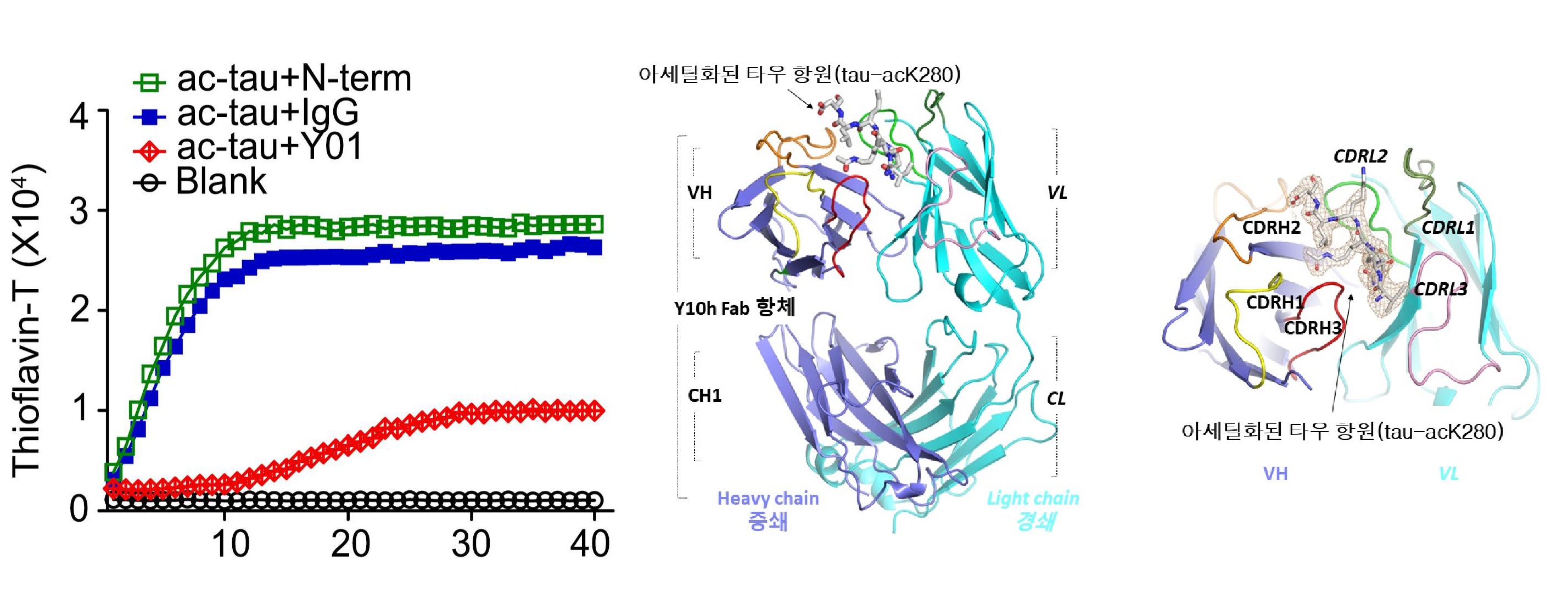
그림 설명
ADEL-Y01항체에 의한 타우 응집 억제 효과(좌), 항체와 아세틸화된 타우 항원 복합체 구조(가운데),
항원의 아세틸화 부위를 특이적으로 인식하는 항체(우)
o ADEL-Y01 항체와 아세틸화된 타우 항원의 복합체 결정 구조 규명에 참가한 연세대 분자구조생물학 연구팀(홍민선 교수, 박재완 연구원, 김명일 연구원)은 ADEL-Y01 항체가 아세틸화된 라이신 280 잔기와 주변 부위를 함유한 항원을 선택적이며 직접적으로 결합하고 있음을 복합체 구조를 통해 제시했다. 이로서 ADEL-Y01 항체가 아세틸화된 타우에 의한 퇴행성 뇌질환의 병리 진행 완화의 분자 기전을 원자 수준으로 증명한다.
o 단일클론항체 ADEL-Y01는 신경 세포와 타우 형질 전환 마우스에서 타우병증 진행을 저해하였고 신경 생존 능력을 증가시켰다. 특히 기존의 N-말단 타우를 표적하는 항체와 비교하여 뇌손상의 원인이 되는 손상된 타우 단백질의 비정상적인 응집을 저해하였고 병리적인 질환의 전파를 억제하는 뛰어난 효과를 보였다.
o 이번 연구는 과학기술정보통신부 중견연구자 지원사업과 보건복지부 비임상개발사업의 지원을 받아 진행됐으며, 국제학술지 임상연구저널(The Journal of Clinical Investigation) 온라인판에 게재되어, JCI 홈페이지(https://www.jci.org/articles/view/156537)를 통해 확인할 수 있다.
※ 이미지 원본 별첨





